




《化学反应速率和限度PPT课件下载(共84页)》是由用户上传到老师板报网,本为文库资料,大小为954.5 KB,总共有84页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 84页
- 954.5 KB
- VIP模板
- ppt
- 数字产品不支持退货
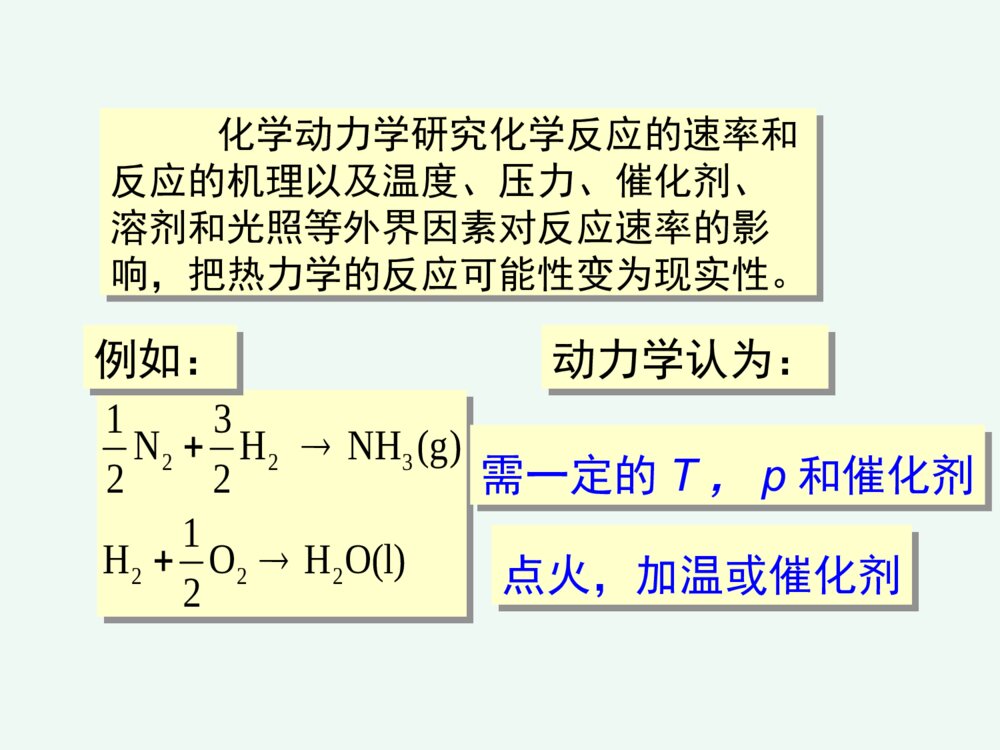
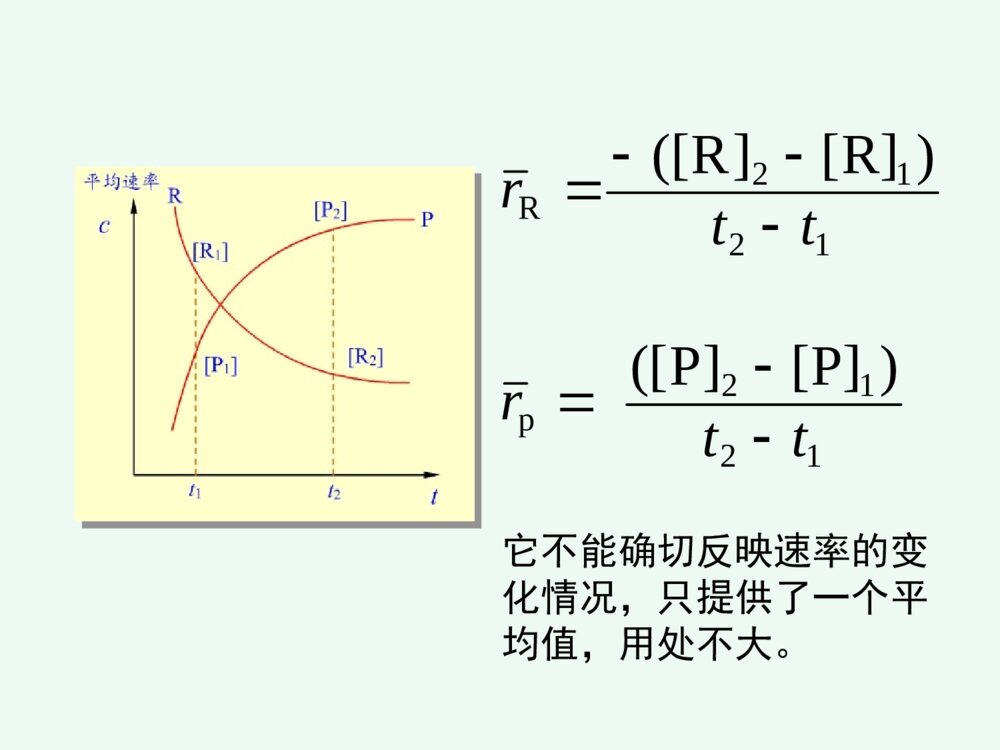
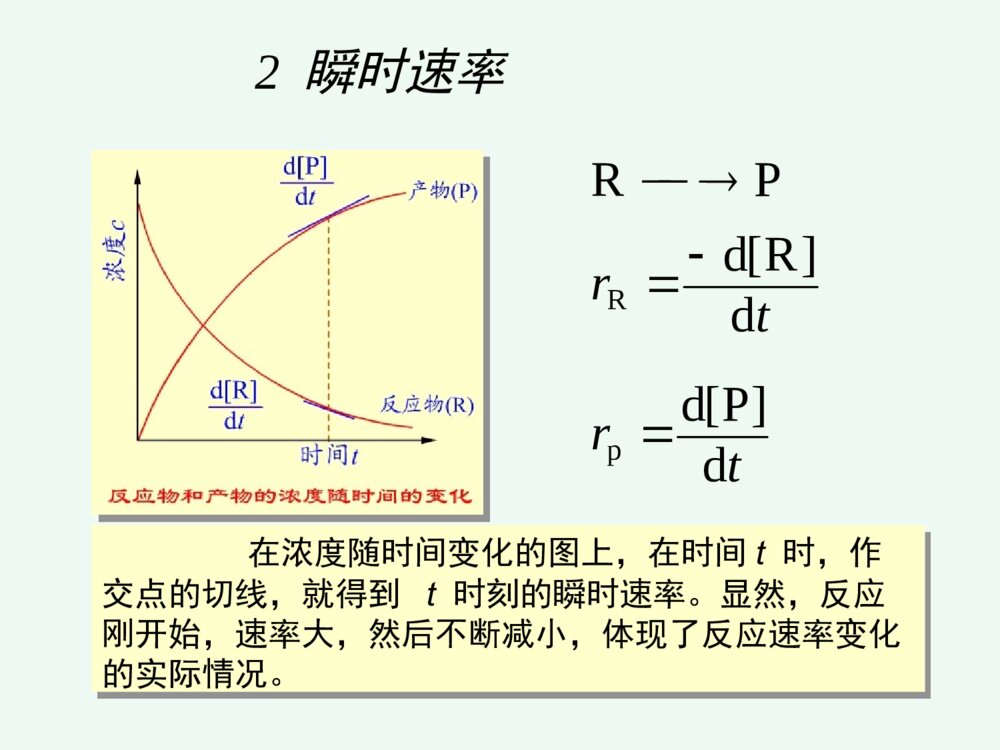
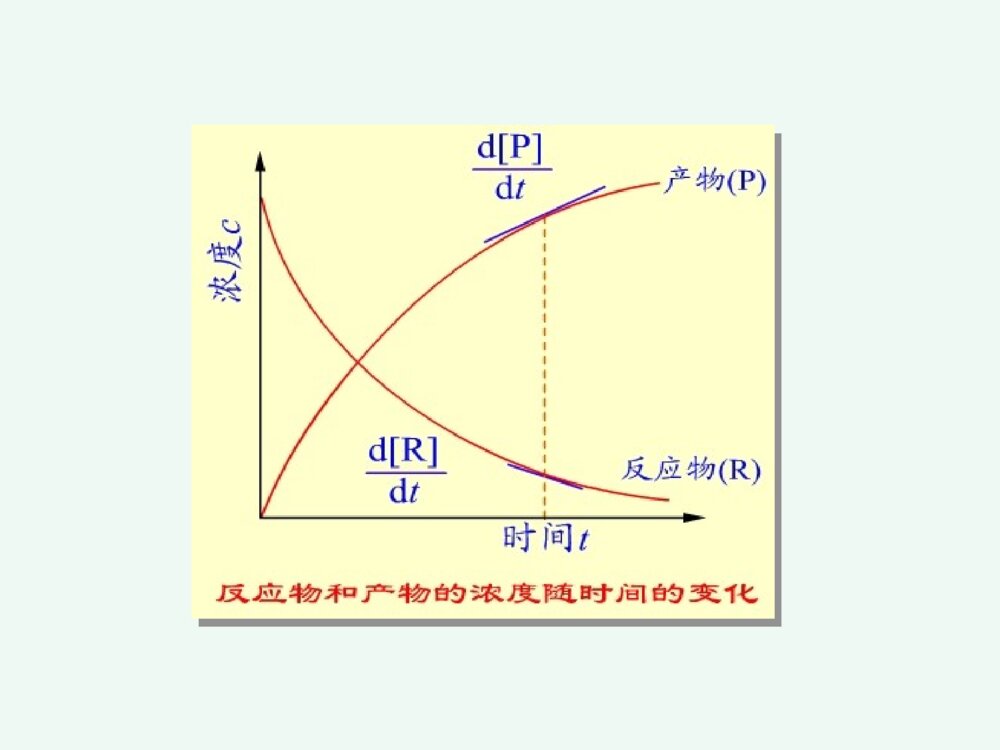
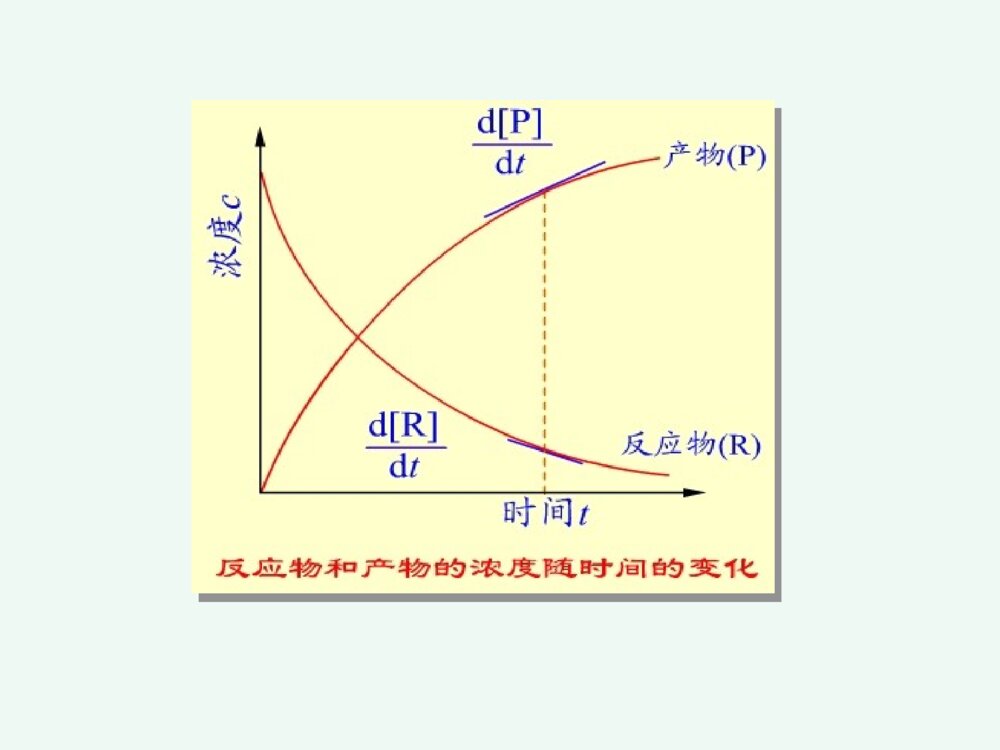
化学反应速率和限度第三章化学反应速率和限度影响化学反应速率的因素化学反应的限度---化学平衡化学反应速率化学动力学研究化学反应的速率和反应的机理以及温度、压力、催化剂、溶剂和光照等外界因素对反应速率的影响,把热力学的反应可能性变为现实性。22322213NHNH(g)221HOHO(l)2例如:动力学认为:需一定的T,p和催化剂点火,加温或催化剂一、化学反应速率的表示方法第一节化学反应速率1平均速率对化学反应,若在等容条件下,单位时间内反应物的减少或生成物的增加tcttccvi1212单位:mol.L-1.时间1212p1212R)P][]P([)R][]R([ttrttr它不能确切反映速率的变化情况,只提供了一个平均值,用处不大。2瞬时速率在浓度随时间变化的图上,在时间t时,作交点的切线,就得到t时刻的瞬时速率。显然,反应刚开始,速率大,然后不断减小,体现了反应速率变化的实际情况。trtrd]P[dd]R[dPRpR国家标准规定:对于化学反应:BΣ0BBν用下式表示以浓度为基础的反应速率:dtdcνB1v化学反应速率的定义:化学反应速率的定义:化学反应:aA+bB=gG+dD化学反应速率为:反应速率:①某一时刻的反应速率、瞬时速率;②平均速率=B–1(ΔcB/Δt)③用反应中的任何物质表示反应速率,数值上都是一样的;④瞬时速率的测定可以由作图法得到。1、化学反应历程(机理)一个化学反应,在一定条件下,反应物变成生成物实际经过的途径基元反应:在反应中反应物分子直接转化成生成物的反应—简单反应复杂反应:在反应中反应物分子经过多步才转化成生成物的反应----非基元反应二、化学反应速率理论化学反应速率理论CO(g)+NO2(g)=CO2(g)+NO(g)基元反应非基元反应H2(g)+I2(g)=2HI(g)I2(g)=2I(g)快H2(g)+2I(g)=2HI(g)慢2、化学反应速率理论化学反应发生的必要条件是反应物分子(或原子、离子)间的碰撞。只有极少数活化分子的碰撞才能发生化学反应,称“有效碰撞”;活化分子是反应物分子中能量较高的分子,其比例很小;(1)有效碰撞理论理论要点:※有效碰撞:能发生反应的碰撞※活化分子:具有较大的动能并且能发生有效碰撞的分子※活化能:活化分子所具有的最低能量与反应物分子的平均能量之差※其他条件相同时,活化能越低的化学反应,反应速率越高。平ECE活E分子分数%分子的能量分布曲线0Ea=E(最低)-E(平)活化能是化学反应的“能垒”,Ea越高,反应越慢;Ea越低,反应越快。Ea可以通过实验测定。RTEaef活化分子反应速率与碰撞频率Z,分子有效碰撞分数f,以及方位因子p有关一般化学反应的活化能约在40~400kj.mol-1之间多数化学反应的活化能约在60~250kj.mol-1之间反应的活化能小于40kj.mol-1时,反应速度很快反应的活化能大于400kj.mol-1时,反应速度很慢中和化学反应的活化能约在13~25kj.mol-1之间例NO2(g)+F2(g)2NO2F(g)反应机理:反应机理:①NO2+F2NO2F+F(慢反应)②F+NO2===NO2F(快反应)反应速率有第①步反应决定。气体反应速率取决于三种因素:反应速率=正确取向的碰撞分数(p)具有足够动能的碰撞分数(f)气体分子碰撞频率(Z)ABZfPv内因:内因:反应的活化能外因:外因:浓度、温度、催化剂一、浓度对化学反应速率的影响一、浓度对化学反应速率的影响11.(基)元反应:.(基)元反应:对于简单反应,反应物分子在有效碰撞中经过一次化学变化就能转化为产物的反应。22.(基)元反应的化学反应速率方程式:.(基)元反应的化学反应速率方程式:可由质量作用定律描述。第二节影响反应速率的因素CO(g)+NO2(g)=CO2(g)+NO(g)基元反应非基元反应H2(g)+I2(g)=2HI(g)I2(g)=2I(g)快H2(g)+2I(g)=2HI(g)慢(速控步骤)(二)反应分子数在基元反应中,同时直接参加反应的粒子的数目,叫做反应分子数。 单分子反应 SO2Cl2=SO2+Cl2 双分子反应NO2+CO=NO+CO2 三分子反应2I+H2=2HI基元反应在一定温度下,对某一基元反应,其反应速率与各反应物浓度(以化学方程式中该物质的计量数为指数)的乘积成正比。如:aA+bB=gG+dD为基元反应,则:BAbackcv称作质量作用定律数学表达式。而对于非基元反应,有:BnAmckcv称作反应速率方程式。其中m、n要通过实验来确定。(a+b)或(m+n)称为反应级数;例2、324282ISO2I3OS非基元反应))((282IOSkv对282OS1级反应,I1级反应,该反应为2级反应。例3、)g(O21)l(OH)aq(OH22221级反应例4、核裂变2262224Ra→Rn+He888621级反应k与温度、催化剂有关,而与浓度无关对于n级反应其单位是(moldm-3)(n-1)s-1k称为反应速率常数,可用来表征反应的速率。反应级数的意义反应级数的意义:①表示了反应速率与物质的量浓度的关系;②零级反应表示了反应速率与反应物浓度无关速率常数的单位速率常数的单位零级反应:=k(cA)0k的量纲为mol·dm-3·s-1一级反应:=kcA;k的量纲为s-1二级反应:=k(cA)2k的量纲为mol3·dm-1·s-1气体反应气体反应可用气体分压表示2NO2→2NO+O2;;或;kckP2NO(2)ckvc2NO(2)Pkvp零级反应在一定温度下,该反应的速率与反应物浓度无关,为一常数,反应速率v=k。如蔗糖的水解反应:C12H22O11+H2OC6H12O6+C6H12O6(蔗糖)(葡萄糖)(果糖)水是大量的,在反应过程中可视水的浓度不变,反应速率只与蔗糖的浓度有关,而与水的浓度无关,即反应对水是零级氨在金属钨的催化下分解为氮和氢的反应也是零级反应NH3(g)N2(g)+H2(g)v=kco(NH3)21W对复杂反应,也有一个相应的速率方程式,但它不是质量作用定律的数学表达式。复杂反应的速率方程式不能直接根据化学方程式写出,可根据实验来确定,或根据定速步骤推导出来2N2O5(g)4NO2(g)+O2(g)r=kc(N2O5)而不是r=kc2(N2O5)机理:N2O5NO3+NO2(慢)NO3NO+O2(快)NO+NO32NO2(快)0级反应ktcddtcctkc0dd0c0-c=ktkckcct22/0002/1一级反应kctcddt0dd0tkccccktcc0lncctk0lg303.2kcckt693.02/lg303.2002/1一级反应ktcc0lncctk0lg303.2kcckt693.02/lg303.2002/1tkcc303.2lglg0lg(c)–t图呈直线是一级反应的特征。半衰期某药物在人体中代谢为一级反应,若上午8时经4,12小时测定血药浓度分别为4.80,2.22mg/L.求k,t1/2,若需保持血药浓度3.7mg/L以上,应在何时注射第二针?解:据lgc~t为直线,可设4小时时为起始点)h(1064.922.280.4lg8303.2lg303.2120cctk至3.7mg/L)h(7.27.380.4lg1064.9303.2lg303.2\'24tttcckt时间t=4+2.7=6.7h即从8:00算起应在约14:42前注射第二针。t1/2=0.693/k=7.19(h)二级反应A+B=ABBABAckctctcdddd设cA0=a,cB0=b,x为产物浓度。则cA=a-x,cB=b-x,为反应t时间后浓度。))((ddxbxaktxx002d)(dttkxax)(xataxkkaaakaat1)2/(2/2/1a=b,即特例2A=A2,2)(ddxaktx011cckt即二、温度对化学反应速率的影响二、温度对化学反应速率的影响11.范特霍夫规则.范特霍夫规则一般情况下:在一定温度范围内,对化学反应温度每升高10度反应速率大约增加到原来的2~4倍。其倍数为反应温度系数ttkk10:温度系数反应速率常数:k当温度从t升高到(t+n*10)时,则反应速率是原来的倍。nntntkk10例1:已知=4,求温度从20°C升温到80°C时,反应速率提高了多少倍?解:根据ntntkk10409646106ttkk2.2.阿仑尼乌斯阿仑尼乌斯(ArrheniusSA)(ArrheniusSA)公式公式1889年瑞典化学家阿累尼乌斯(ArrheniusSA)在总结大量实验事实的基础上,提出了反应速率常数与温度的定量关系式lnAlnRTEkaRTEaeAk/或AA::反应的指前因子,对确定的化学反应是一常数,A与k同一量纲;EEaa::反应活化能;RR::8.314J·mol-1·K-1TT::热力学温度温度微小的变化将导致k值较大的变化。阿仑尼乌斯公式的应用阿仑尼乌斯公式的应用求出任一温度下该反应的k值①作图法做图斜率②根据二点进行计算或ARTEkalg303.2lgTk1lgREsa303.2)(ln121212TTTTRTEkka)(303.2lg121212TTTTRTEkka由阿仑尼乌斯公式,得出以下结论:(1)对Ea不同的各化学反应,若A相近,则在同一温度条件下,Ea越大,k越小。(2)活化能高的化学反应,其速率常数随温度的变化率越大;活化能低的化学反应,速率常数随温度变化率小。(3)同一化学反应,温度变化相同时,高温区反应速率增大的幅度比低温去大。三、催化剂对化学反应速率的影响三、催化剂对化学反应速率的影响催化剂能改变反应速率的作用叫催化作用。正催化:加速反应速率负催化:减慢反应速率1.1.催化剂影响化学反应速率的原因催化剂影响化学反应速率的原因催化作用的实质是改变了反应的机理,降低了反应的活化能,因而提高了反应速率。不改变反应的自由能,也不改变平衡常数K;缩短平衡到达的时间,加快平衡的到来。催化剂正催化剂负催化剂改变反应途径改变反应速率,但反应前后本身组成和质量不变的物质改变反应的活化能改变活化分子数反应速度⑴高效性(用量少,作用大)⑵选择性一种催化剂只能催化一种或几种反应;同一反应用不同催化剂得到不同产物。⑶反应前后组成和质量不变特点:(4)酶的活性要在一定温度、一定pH范围时才最大。生物催化剂----酶生物体内,氧化、还原、合成、降解、水解、基因转移与转变等,在酶催化下迅速完成。例如反应:A+BAB活化能为Ea当有催化剂Z存在时,改变了反应的途径,使之分为两步A+ZAZ(1)活化能为E1AZ+BAB+Z(2)活化能为E2由于E1,E2均小于Ea,所以反应加快了。催化剂加速反应速率往往是很惊人的。例如,用接触法生产硫酸,关键的步骤是:2SO2+O2=2SO3催化剂V2O5可使反应速率增大1亿多倍。催化剂在加速正反应的同时,也以同样的倍数加快逆反应的速率。所以催化剂只能加速化学平衡的到达,不能改变化学平衡的位置。此外,还必须指出,催化剂虽可改变反应的活化能,但不能改变反应的△rG。因此对一个△rG>0的反应,不能用催化剂促使其自发。催化作用的特点:1.物理性质在反应前后可能有变化。2.少量催化剂就能使反应速率改变很大。3.同时加大正逆两方向的速率,不能影响平衡状态。4.具有选择性(例如乙烯的氧化)。5.催化剂中毒。催化作用理论•均相催化理论――中间产物学说•多相催化理论――活性中心学说A+CACAC+BAB+C形成中间产物改变了反应途径,从而降低反应的活化能。催化作用理论•多相催化理论――活性中心学说¤活性中心占固体催化剂表面积的小部分,但具有较高的催化效率,易于发生化学吸附,形成新化学键。¤催化剂一般易发生催化剂中毒。1.反应物向催化剂表面扩散。2.反应物吸附在催化剂表面。3.在催化剂表面上发生化学反应。4.生成物从催化剂表面上解吸。5.生成物离开催化剂表面扩散开去。影响多相反应速率的因素 在多相系统中,只有在相的界面上,反应才能发生。因此,扩散速度、吸附和解吸、固体催化剂总面积、反应物分子的粒径等等,都会影响到反应的速率。 对于多相反应,固体和纯液体不表示在反应速率方程式中,如:对于反应:C(s)+O2(g)===CO2(g)其速率方程式为:υ=kc(O2)酶enzyme★条件要求高:pH,T等,但较温和★高度专一性★高效性★高选择性第三节化学反应的限度—化学平衡一、化学平衡状态一、化学平衡状态1.化学平衡及特征在一定条件下,既能向正方向进行又能向逆方向进行的反应称可逆反应。如反应:CO(g)+H2O(g)H2(g)+CO2(g)在高温下CO与H2O能反应生成H2和CO2,同时H2与CO2也能反应生成CO和H2O。对这样的反应,为强调可逆性,在反应式中常用代替等号。化学平衡及特征达到平衡的时间(平衡线)t几乎所有反应都是可逆的,只是有些反应在已知的条件下逆反应进行的程度极为微小,以致可以忽略,这样的反应通常称之为不可逆。如KClO3加热分解便是不可逆反应的例子。可逆反应在进行到一定程度,便会建立起平衡。例如,一定温度下,将一定量的CO和H2O加入到一个密闭容器中。反应开始时,CO和H2O的浓度较大,正反应速率较大。一旦有CO2和H2生成,就产生逆反应。开始时逆反应速率较小,随着反应进行,反应物的浓度减少,生成物的浓度逐渐增大。正反应速率逐渐减少,逆反应速率逐渐增大。当正、逆反应速率相等时,即达到平衡状态。正、逆反应速率相等时的状态叫做化学平衡。化学平衡有两个特征:(1)化学平衡是一种动态平衡。表面上看来反应似乎已停止,实际上正逆反应仍在进行,只是单位时间内,反应物因正反应消耗的分子数恰等于由逆反应生成的分子数。(2)化学平衡是暂时的、有条件的平衡。当外界条件改变时,原有的平衡即被破坏,直到在新的条件下建立新的平衡。2.化学平衡常数化学反应处于平衡状态时各物质的浓度称为平衡浓度对于反应H2(g)+I2(g)=2HI(g),在718时,实验测得数据。)()()(222ICHCHIC 开始浓度/mol·L-1平衡浓度/mol·L-1C(H2)C(I2)C(HI)C(H2)C(I2)C(HI)123450.020000.002050.02060.00790.020000.01330.01450.019200.04000.052400.02570.004350.004350.003350.007750.002050.004350.004350.01460.001650.01330.03130.03130.04980.02570.037451.851.851.751.751.3H2(g)、I2(g)、HI(g)的平衡浓度和平衡常数(718K)看出,在718K当反应达平衡时,虽然各组体系内各物质的浓度不同,但生成物浓度(以反应方程式中的计量系数为指数)的乘积与反应物浓度(以反应方程式中的计量系数为指数)的乘积之比是一个常数:)()()(222IcHcHIcKc=对一般可逆反应2.化学平衡常数(1)实验平衡常数当可逆反应达到平衡时,反应物和生成物的浓度将不再改变。对一般可逆反应:aA+bBdD+eE在一定温度下达平衡时,由动力学方程关系式:BAbackcvBAbackcv2.化学平衡常数(1)实验平衡常数在一定温度下液相达平衡时,都能建立如下的关系式:)()()()(cbaedKBcAcEcDcKc为浓度平衡常数;单位:(mol·dm-3)B B=(g+d)–(a+b)B=0时,Kc量纲为1,B0时,Kc有量纲aA+bBdD+eE生成物浓度幂的乘积,除以反应物浓度幂的乘积为一常数Kc。由上式可见,Kc值越大,表明反应在平衡时生成物浓度的乘积越大,反应物浓度的乘积越小,所以反应进行的程度越高。对气体反应,还可用气体的分压代替浓度。平衡常数表达式可写成Kp,称压力经验平衡常数。Kp为压力平衡常数 B=0时,Kp量纲为1B0时,Kp有量纲aA(g)+bB(g)dD(g)+eE(g)Kp=)()()()(BpApEpDpbaed式中(A)、(B)、(D)、(E)分别代表A、B、D、E各物质的平衡分压。如反应:例如生成HI反应H2(g)+I2(g)2HI(g)平衡常数表达式可写成Kp,称压力经验平衡常数。p222)(I)(H(HI)KpppKP与KC的关系反应物生成物都近乎理想气体气态方程p=cRTKP=KC(RT)(只应用于单纯气态反应)=0时,KP=KcBBBB(2)标准平衡常数(热力学平衡常数) 简称平衡常数,符号Kθ.对气相反应:aA(g)+bB(g)gG(g)+dD(g)bagdpBppAppGppDpK]/)([]/)([]/)([]/)([式中p(D)/pθ、p(G)/pθ、p(A)/pθ、p(B)/pθ分别为D、G、A、B平衡时的相对分压;标准压力pθ=100kPa。溶液中的反应aA+bBgG+dDbagdcBccAccGccDcK]/)([]/)([]/)([]/)([式中c(D)/cθ、c(G)/cθ、c(A)/cθ、c(B)/cθ分别为D、G、A、B平衡时的相对浓度,标准浓度cθ=1mol·L-1。Kθ的量纲为一。对于复相反应 Zn(S)+2H+(aq)H2(g)+Zn2+(aq)222]/)([]/)(][/)([cHccZncpHpK书写和应用平衡常数的几点说明:①平衡常数表达式需与反应方程式相对应 例N2(g)+3H2(g)2NH3(g)K1=1.601051/2N2(g)+3/2H2(g)NH3(g)K2=3.87102 K1K2,K1=K22如合成氨反应①N2+3H2=2NH332223]/)(][/)([]/)([ooopHppNppNHp=oK1②N2+H2=NH32123oK2=2321]/)([]/)([]/)([223ooopHppNppNHp③NH3=N2+H22321oK3=]/)([]/)([]/)([3222321ooopNHppHppNp显然,,而是==1/030201KKK01K02K03K②纯固体与纯液态及水溶液中参加反应的水的浓度在平衡常数表达式中不出现;例:Cr2O72+H2O2CrO42+2H+ 例:Ca2CO3(s)===CaO+CO2]/)([]/)([)]/)([2722224cOCrccHccCrOcKpCOpK)(2③平衡常数只表现反应进行的程度,即可能性问题,而不表现到达平衡所需的时间,即现实性问题;Kθ越大,反应越彻底,反应倾向性越大;Kθ>107正向进行;Kθ<107逆向进行。例2SO2(g)+O2(g)=2SO3(g)298K时,Kθ=3.61024④多重平衡规则若干方程式相加(减),则总反应的平衡常数等于分步平衡常数之积(商)(T相同)例:2NO(g)+O2(g)2NO2K1θ2NO2(g)N2O4K2θ2NO(g)+O2(g)N2O4(g)Kθ=K1θK2θ例:C(s)+CO2(g)2CO(g)KθC(s)+H2O(g)CO(g)+H2(g)K1θCO(g)+H2O(g)CO2(g)+H2(g)K2θKθ=K1θ/K2θ⑤标准平衡常数Kθ与温度有关,因此要注明Kθ的温度条件,通常一个温度下同一化学反应只有一个Kθ。⑥上述平衡常数与平衡体系各组分分压或浓度的关系,严格地说只是对于气体分压不太高,溶质的浓度比较稀的情况下适用。⑦在热力学中平衡常数没有压力和浓度平衡常数的区别。二、化学反应等温式-范特霍夫方程●标准态下:Gθ<0,自发过程;Gθ>0,非自发过程;Gθ=0,平衡状态。●非标准态下:rGm>0,rGm<0,rGm=0判断反应过程的自发性。化学反应均是在非标准状态下的反应,非标态下的自由能变rGm与标态下的自由能变rGmθ之间具有怎样的关系式?根据热力学推导,二者之间的关系为:rG=rGmθ+RTlnQT——化学反应等温式QT称为反应商(1).对于气体反应aA+bB=gG+dD,(pG/p)ˊg·(pD/p)ˊdQT=(pA/p)ˊa·(pB/p)ˊbrGm=rGm+RTlnQT当rGm=0时,反应达平衡状态,此时QT即为KT,故有:rGm+RTlnKT=0rGm=-RTlnKT(2).溶液相的反应aA+bBgG+dD[c(G)/cθ]ˊg·[c(D)/cθ]ˊdrGm=rGmθ+RTln[c(A)/cθ]ˊa·[c(B)/cθ]ˊbrGm=rGmθ+RTlnQTΔrGm=-RTlnKo+RTlnQ=RTlnoKQrGm=-RTlnKT化学反应的等温方程式ΔrGm=-RTlnKo+RTlnQ=RTlnoKQ化学反应的等温方程式rGm=rGmθ+RTlnQTrGm=-RTlnKT该式表明在一定温度和压力下,化学反应自由能变ΔrGm与各反应物、生成物相对分压之间的关系。根据此式可以判断处于任意状态下反应自发进行的方向。注意:omGΔrGmoK的温度要一致



















